BIOCRYST – IC BARI
DESCRIZIONE DELLE ATTIVITA’ DI RICERCA E RIFERIMENTI DELLA PERSONA DI CONTATTO:
Cristallizzazione e caratterizzazione strutturale di macromolecole biologiche e composti proteina-ligando (BioCryst)
L’attività del gruppo BioCryst riguarda lo studio strutturale di macromolecole biologiche condotto con tecniche cristallografiche e coadiuvato da modellistica computazionale. L’obiettivo è molteplice: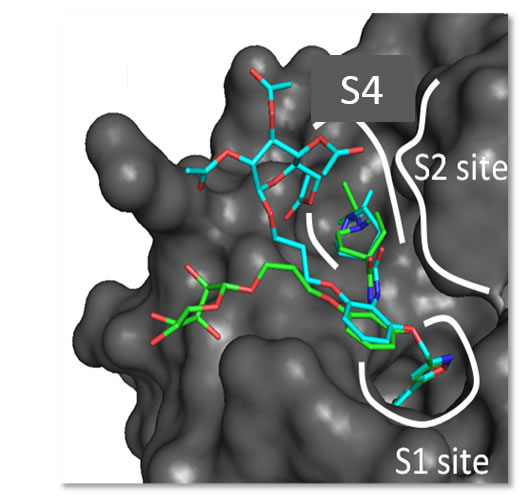
- determinare la struttura di proteine di interesse farmacologico o biotecnologico;
- studiare ii movimenti funzionali delle proteine attraverso simulazioni applicate alla struttura sperimentale;
- progettare mutazioni sito-specifiche su proteine che possano portare ad un miglioramento della loro funzionalità;
- studiare l’interazione di potenziali farmaci con proteine target;
progettare farmaci più attivi e selettivi in base all’informazione strutturale ottenuta sperimentalmente.
 L’attività di cristallizzazione di proteine è propedeutica allo studio strutturale tramite diffrazione a raggi X, e spesso ne rappresenta il fattore limitante. Il gruppo svolge tale attività usando tecniche consolidate (diffusione di vapore, batch) e sviluppa nuove tecniche basate sull’utilizzo di materiali compositi formati da membrane, idrogels e nanoparticelle. Oltre che per scopi di ricerca, la cristallizzazione di proteine è applicata a processi biotecnologici e industriali quali packaging attivo di alimenti, bioreattori catalitici e purificazione di prodotti farmaceutici ad alto valore aggiunto.
L’attività di cristallizzazione di proteine è propedeutica allo studio strutturale tramite diffrazione a raggi X, e spesso ne rappresenta il fattore limitante. Il gruppo svolge tale attività usando tecniche consolidate (diffusione di vapore, batch) e sviluppa nuove tecniche basate sull’utilizzo di materiali compositi formati da membrane, idrogels e nanoparticelle. Oltre che per scopi di ricerca, la cristallizzazione di proteine è applicata a processi biotecnologici e industriali quali packaging attivo di alimenti, bioreattori catalitici e purificazione di prodotti farmaceutici ad alto valore aggiunto.
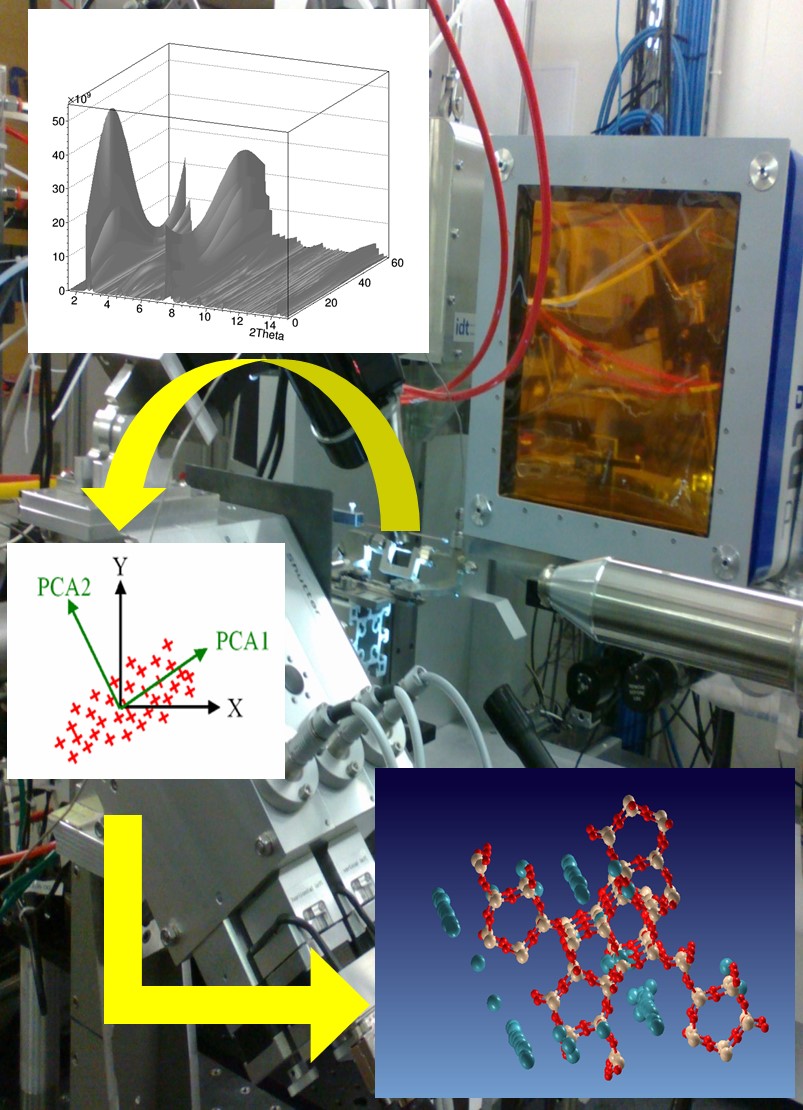
Il gruppo BioCryst si occupa anche della caratterizzazione strutturale di campioni sottoposti a stimoli esterni durante il processo di misura. Sono state sviluppate tecniche sperimentali e algoritmi di processamento dei dati che permettono di ottenere in maniera automatica e immediata informazioni sulla cinetica delle trasformazioni a stato solido che intervengono sul campione e sugli atomi coinvolti nei cambiamenti strutturali. In particolare è possibile determinare le variazioni strutturali dei soli atomi “attivi”, cioè che rispondono allo stimolo esercitato durante la misura, pur non conoscendo l’intera struttura del materiale. Tali tecniche sono applicate sia a materiali avanzati di interesse tecnologico, ambientale o medico, che a sistemi biologici.
Persona di contatto: ROCCO CALIANDRO
e-mail: rocco.caliandroATic.cnr.it
Tel : 0805929150
PERSONALE COINVOLTO:
Benny Danilo Belviso (postdoc)
Valentina Mirabelli (PhD)
FACILITIES E LABORATORI A DISPOSIZIONE:
 Laboratorio di biocrstallografia
Laboratorio di biocrstallografia
Linea sincrotrone XRD1 di ELETTRA, alla quale i membri del gruppo hanno accesso privilegiato.
Principali sincrotroni europei quali European Synchrotron Radiation Facility (Grenoble, Francia) e Diamond Light Source (Didcot, UK), ai quali i membri del gruppo hanno accesso tramite progetti a lungo termine.
Principali sincrotroni al mondo quali il National Synchrotron Light Source II (Brookhavem, USA) e il Pohang Light Source, (Pohang, Korea), ai quali I membri del gruppo hanno accesso tramite progetti in collaborazione con gruppi locali.
PROGETTI DI RICERCA NEL GRUPPO:
- Progetto Amecrys
- Progetto bilaterale Corea del Sud
PUBBLICAZIONI NEL GRUPPO:
- Oxaliplatin Binding to Human Copper Chaperone Atox1 and Protein DimerizationBD Belviso, A Galliani, A Lasorsa, V Mirabelli, R Caliandro, F Arnesano, …Inorganic chemistry 55 (13), 6563-6573
- Bioinspired Synthesis of CaCO3 Superstructures through a Novel Hydrogel Composite Membranes Mineralization Platform: A Comprehensive ViewG Di Profio, SM Salehi, R Caliandro, P Guccione, G Nico, E Curcio, …Advanced Materials 28 (4), 610-616
- How a β-D-glucoside side chain enhances binding affinity to thrombin of inhibitors bearing 2-chlorothiophene as P1 moiety: crystallography, fragment deconstruction…BD Belviso, R Caliandro, M de Candia, G Zaetta, G Lopopolo, F Incampo, …Journal of medicinal chemistry 57 (20), 8563-8575
- Tailored hydrogel membranes for efficient protein crystallizationGD Profio, M Polino, FP Nicoletta, BD Belviso, R Caliandro, …Advanced Functional Materials 24 (11), 1582-1590
- Tailored multivariate analysis for modulated enhanced diffractionR Caliandro, P Guccione, G Nico, G Tutuncu, JC HansonJournal of Applied Crystallography 48 (6), 1679-1691
