Studio delle interazioni biomolecolari e screening di librerie di composti mediante Surface Plasmon Resonance (SPR)
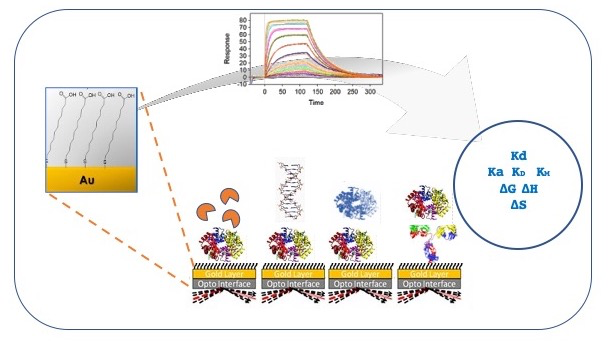
L’attività del laboratorio SPR è dedicata alla caratterizzazione delle interazioni tra molecole biologiche, che consente di calcolare le costanti cinetiche, l’affinità e la stechiometria del legame. L’elevata sensibilità della strumentazione permette l’analisi dell’interazione anche con piccole molecole e screening di librerie di composti.
La tecnica SPR si basa su un biosensore che consente, attraverso esperimenti in tempo reale e senza necessità di marcatura dei campioni, di analizzare le interazioni tra molecole biologiche (e.g. proteine, DNA, anticorpi, peptidi, vescicole) con elevata sensibilità e rapidità. L’analisi consente di caratterizzare la cinetica di associazione e dissociazione, l’affinità e la stechiometria di un’interazione, ma può essere utilizzata anche per ottenere informazioni termodinamiche, per determinare la concentrazione di un componente in una miscela o per effettuare screening e selezione di anticorpi.
Il laboratorio SPR di IC-CNR è dotato di un SensiQ Pioneer AE, una piattaforma ad elevate prestazioni e completa automazione. Questo strumento ad alta sensibilità fornisce dati accurati anche con piccole molecole (<70 Da) e può essere quindi utilizzato, oltre che per le applicazioni tradizionali, anche per lo screening di ampie librerie di composti.
L’attività di ricerca del nostro gruppo, nell’ambito di vari progetti e collaborazioni, è rivolta principalmente alla scoperta di nuovi farmaci e allo studio della relazione struttura/funzione di biomolecole (es. recettori nucleari, proteine di membrana, enzimi).
– Capelli D. et al. “Surface Plasmon Resonance as a tool for ligand binding investigation of engineered GPR17 receptor, a G protein coupled receptor involved in myelinization”. Front Chem 2020; 7:910.
– Montanari R. et al. “Screening of saponins and sapogenins from Medicago species as potential PPARγ agonists and X-ray structure of the complex PPARγ/caulophyllogenin”. Sci Rep 2016; 6:27658.
– Boi D. et al. “PHA-680626 Is an Effective Inhibitor of the Interaction between Aurora-A and N-Myc”. Int J Mol Sci 2021; 22(23):13122
– Spizzichino S. et al. “Cytosolic localization and in vitro assembly of human de novo thymidylate synthesis complex”. FEBS J 2021; 289(6):1625-1649


