Studio strutturale delle interazioni proteina/ligando ad alta risoluzione
Caratterizzazione strutturale di bio-macromolecole in presenza di composti di interesse farmacologico/biotecnologico al fine di fornire informazioni utili alla ottimizzazione di questi ultimi e all’individuazione del meccanismo molecolare alla base della loro interazione con la macromolecola.
La descrizione dell’interazione tra una macromolecola biologica ed una piccola molecola è una informazione di primaria importanza sia per l’ottimizzazione della molecola stessa, nel caso di composti di interesse farmaceutico/biotecnologico, che, nel caso di cofattori, molecole e ioni che naturalmente interagiscono con la macromolecola, per la comprensione dei meccanismi biochimici che coinvolgono la macromolecola.
L’ottenimento di tale informazione è al centro di questa linea di ricerca.
In particolare, il nostro lavoro si concentra sugli aspetti strutturali dell’interazione macromolecola biologica/piccola molecola che vengono studiati utilizzando tecniche di diffrazione (MX) e assorbimento (XAS) ai raggi X in grado di produrre informazioni ad alto livello di risoluzione. Mediante l’uso di tali tecniche, sono state da noi studiate macromolecole coinvolte in diversi processi biochimici come l’apoptosi, la metilazione del DNA, la proteolisi intra ed extra cellulare e l’omeostasi dei metalli. L’informazione ad alta risoluzione prodotta e l’uso di tecniche come il fragment/structure based molecular design hanno consentito lo sviluppo di inibitori, modulatori allosterici sintetici, antenne molecolari per applicazioni in campo fotovoltaico nonché per l’ottimizzazione di proteine di interesse in campo biotecnologico.
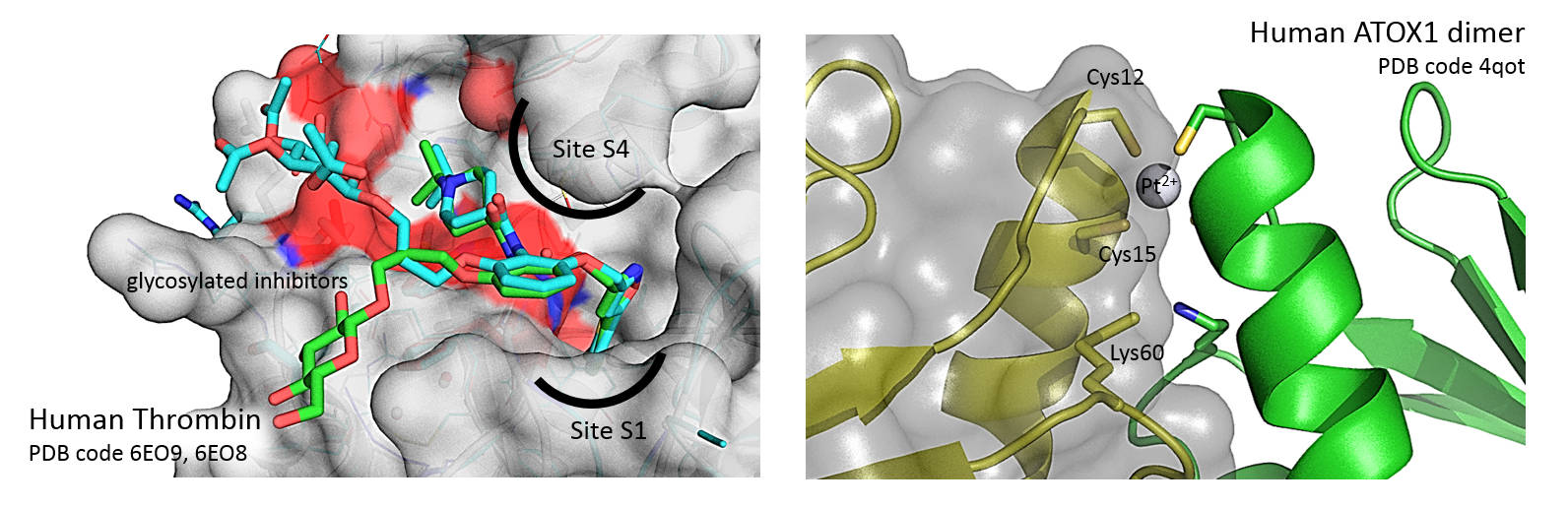
– BD Belviso, A Galliani, A Lasorsa, V Mirabelli, R Caliandro, F Arnesano, and G Natile, Oxaliplatin Binding to Human Copper Chaperone Atox1 and Protein Dimerization, Inorganic Chemistry, 2016, 55 (13), 6563-6573, DOI: 10.1021/acs.inorgchem.6b00750
– BD Belviso, R Caliandro, M de Candia, G Zaetta, G Lopopolo, F Incampo, M Colucci, and CD Altomare, How a β-D-Glucoside Side Chain Enhances Binding Affinity to Thrombin of Inhibitors Bearing 2-Chlorothiophene as P1 Moiety: Crystallography, Fragment Deconstruction Study and Evaluation of Antithrombotic Properties, Journal of Medicinal Chemistry, 2014, 57 (20), 8563-8575, DOI: 10.1021/jm5010754
– BD Belviso, R Caliandro, D Siliqi, V Calderone, F Arnesano, and G Natile, Structure of matrix metalloproteinase-3 with a platinum-based inhibitor, Chemical Communications, 2013,49, 5492-5494, DOI: 10.1039/C3CC41278D
– M Catto, L Pisani, E de la Mora, BD Belviso, GF Mangiatordi, A Pinto, A De Palma, N Denora, R Caliandro, Jacques-Philippe Colletier, Israel Silman, Orazio Nicolotti, and Cosimo Damiano Altomare, Chiral Separation, X-ray Structure and Biological Evaluation of a Potent and Reversible Dual Binding Site AChE Inhibitor, ACS Medicinal Chemistry Letters 2020 11 (5), 869-876, DOI: 10.1021/acsmedchemlett.9b00656


