Molecole e meccanismi regolatori della proteostasi nelle patologie da misfolding proteico
L’alterazione della proteostasi, ovvero il controllo della integrità del proteoma, è alla base di molte patologie (es. cancro, Alzheimer, Parkinson e diabete). L’attività di ricerca è finalizzata al design di piccole molecole in grado di ripristinare la proteostasi cellulare.
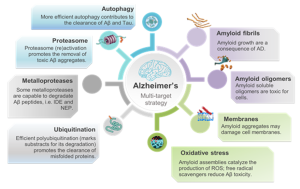
Vi è una crescente urgenza di trovare nuovi farmaci per il trattamento delle malattie da misfolding proteico (PMDs), tra cui il diabete mellito di tipo II (T2DM) e il morbo di Alzheimer (AD). Sulla base dell’”ipotesi dell’amiloide”, molti sforzi sono stati dedicati alla progettazione di molecole in grado di arrestare la progressione della malattia inibendo la crescita dell’amiloide. Sfortunatamente, tutti questi tentativi si sono rivelati finora infruttuosi, suggerendo che è necessaria una conoscenza più dettagliata di tutti gli eventi molecolari che portano al danno cellulare. È noto che le cellule esprimono una serie orchestrata di macchinari proteolitici che controllano l’omeostasi proteica (proteostasi) in un determinato intervallo di condizioni ambientali avverse. Questo gruppo conduce ricerche all’avanguardia tra la chimica biologica e fisica concentrandosi sulla progettazione di piccole molecole (es. composti naturali, porfirine, pirazoloni ecc.) volte a ripristinare l’intera rete di proteostasi, piuttosto che semplicemente inibire l’aggregazione proteica tossica. Il nostro lavoro abbraccia la scienza fondamentale relativa alla termodinamica della stabilità proteica e delle interazioni proteina-proteina (PPis) fino alle applicazioni nella chimica medicinale per lo sviluppo di bioconiugati, coinvolgendo interfacce chimicamente personalizzate tra lipidi, proteine, acidi nucleici, piccole molecole e ioni metallici
– D. Milardi, E. Gazit, S. E. Radford, Y. Xu, R. U. Gallardo, A. Caflisch, G. T. Westermark, P. Westermark, C. La Rosa, and A. Ramamoorthy, Proteostasis of Islet Amyloid Polypeptide: A Molecular Perspective of Risk Factors and Protective Strategies for Type II Diabetes, Chem. Rev. (2021), 121, 1845−1893.
– F. Bellia, V. Lanza, S. Garcıa-Vinuales, I. M. M. Ahmed, A. Pietropaolo, C. Iacobucci, G. Malgieri, G. D’Abrosca, R. Fattorusso, V. G. Nicoletti, D. Sbardella, G. R. Tundo, M. Coletta, L. Pirone, E. Pedone, D. Calcagno, G. Grasso and D. Milardi, Ubiquitin binds the amyloid b peptide and interferes with its clearance pathways, Chem. Sci. (2019), 10, 2732-2742.
– G. Malgieri, G. D’Abrosca, L. Pirone, A. Toto, M. Palmieri, L. Russo, M. F. M. Sciacca, R. Tatè, V. Sivo, I. Baglivo, R. Majewska, M. Coletta, P. V. Pedone, C. Isernia, M. De Stefano, S. Gianni, E. M. Pedone, D. Milardi* and R. Fattorusso*, Folding mechanisms steer the amyloid fibril formation propensity of highly homologous proteins, Chem. Sci., (2018), 9, 3290–3298.
– A. M. Santoro, A. Cunsolo, A. D’Urso, D. Sbardella, G. R. Tundo, C. Ciaccio, M. Coletta,* D. Diana, R. Fattorusso,* M. Persico, A. Di Dato, C. Fattorusso, D. Milardi* and R. Purrello*, Cationic porphyrins are tunable gatekeepers of the 20S proteasome, Chem. Sci., (2016), 7, 1286–1297.


